传染病检测有两种方式:检测病原体或者检测人体为了抵抗病原体而产生的抗体。其中病原体检测可通过抗原检测或者核酸检测方法进行,在COVID-19全球范围内爆发传播后,基于分子水平的核酸检测技术逐渐成为病原体检测的重要手段。目前,用于病原体检测的主流技术有哪些?一起来看看!
荧光定量RT-PCR技术
荧光定量RT-PCR技术是将提取出的病毒RNA逆转录成cDNA,然后对合成的cDNA进行扩增,再利用荧光探针检测扩增产物,通过扩增产物中的荧光信号来判断样本中是否含有病毒序列。荧光定量RT-PCR技术是世界各国疾控中心(CDC)采用的金标准,可以检测患者样本中微小病原体,是传染病病毒传播早期诊断的主要方法。

图1 RT-PCR检测流程图
逆转录等温扩增技术
逆转录等温扩增技术是在恒定温度下,通过添加不同活性的酶和各自特异性的引物来达到快速扩增核酸的目的。等温扩增技术近年来发展迅速,摆脱了对热循环仪的依赖,在现场诊断方面显示出较强的优越性。目前主流的技术有环介导等温扩增(Loop-mediated isothermal amplication,LAMP)、连置换扩增(strand displacement amplification,SDA)、滚环核酸扩增技术(rolling cricle amplification)、依赖核酸序列扩增技术(nucleicacid sequence-based amplification,NASBA)。LAMP具有高度特异性,识别DNA/RNA靶标特定位置可高达8个,也被称为“八倍镜”,它是众多等温扩增技术中研究和应用较为成熟的,在及时检测POCT(Point of Care Testing)中发挥重大作用。NASBA是一种简单的等温信号放大法,在监测和控制动物疾病传播方面广泛应用。
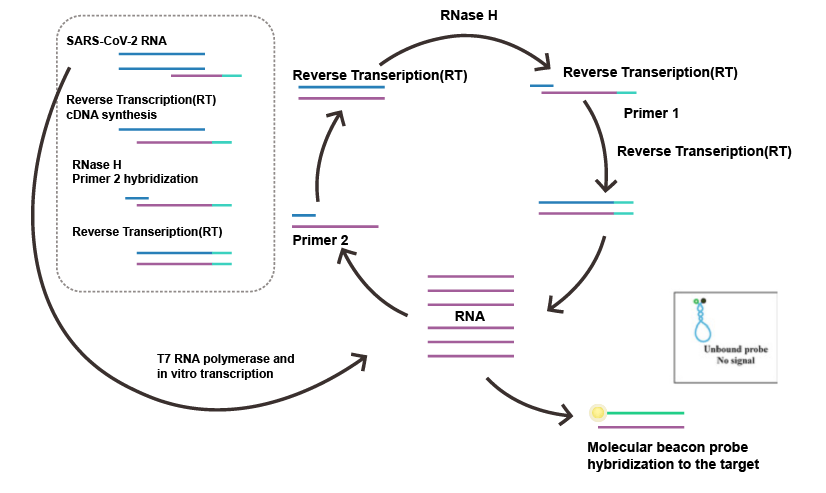
图2 依赖核酸序列扩增技术(NASBA)检测SARS-CoV-2病毒流程图
NGS测序法
NGS测序法常用的原理是桥式PCR扩增,通过模板DNA分子的化学修饰,将其锚定在纳米孔或者微载体芯片上,利用碱基互补配对原则,通过采集荧光标记信号或化学反应信号,实现碱基序列的解读。NGS一次性可完成几十万至几百万条序列的测定,可在基因组水平对未知病毒进行从头测序,获得病原体的基因序列。与RT-PCR相比,NGS可以提供更多的病毒序列和分型信息,是识别未知病原体的有力工具。
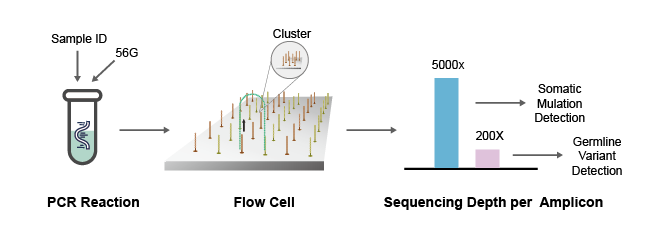
图3 NGS测序法检测病毒流程图
CRISPR检测法
CRISPR检测法的诊断机制与基因编辑相似,在sgRNA的引导下,CRISPR-Cas蛋白识别靶标序列后,Cas12a、Cas13a和Cas14a内切酶被激活,对靶标核酸进行切割,产生荧光信号,达到检测目的。相对于qPCR等温扩增技术而言,CRIPSR检测技术采取等温扩增与Cas酶的反式切割结合的方法进行检测,借助sgRNA的特异性识别,即提高等温扩增后的特异性,又实现了现场快速检测(POCT)。CRISPR诊断方法被称为下一代分子诊断技术,有望引起体外诊断领域的新变革。

图4 CRISPR-Cas12a系统检测病毒流程图
如何选择检测方法?

必威生物
引物探针设计与合成
无论选择哪种检测方法,都离不开核心原材料引物探针,高质量的特异性引物探针可大大提高实验效率、检测准确性。必威生物为您提供高质量引物探针设计与合成!精准的引物探针设计,先进的制造工艺和高效的交付周期,助您迅速开展病原体检测。我们提供qPCR探针、FISH探针、分子信标探针、NGS等不同类型的核酸探针,还可为您提供定制化引物探针设计与合成服务,满足您在分子诊断领域的各种应用需求。
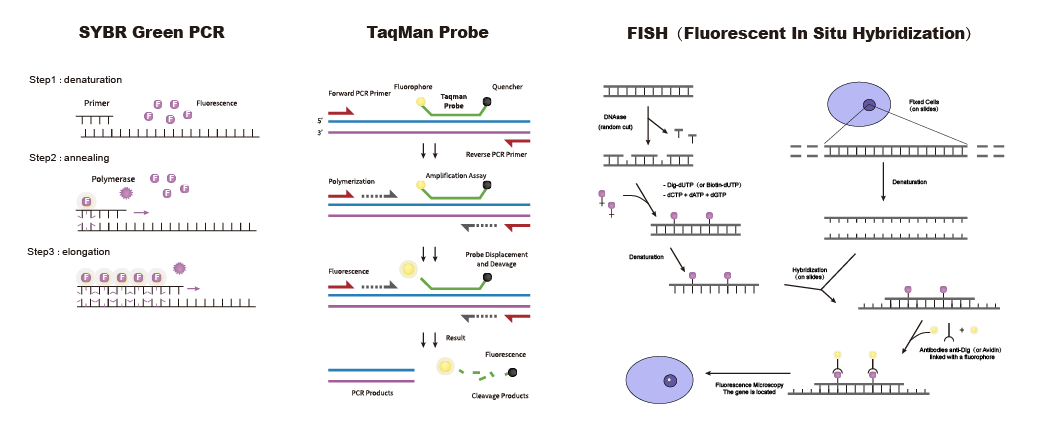
图5三种探针示意图
必威案例
引物合成是由单个碱基顺次连接合成。每处碱基的合成需要完成脱保护、缩合连接、乙酰化封闭、氧化稳定四个步骤,加之化学反应自身的效率问题,最终会导致引物产物无法达到100%的纯度。所以,化学合成的效率直接影响粗产物的纯度,同时也限制了合成引物的长度(一般超过150nt的引物推荐使用基因合成或其它分子生物学的方法制备)。
必威生物升级纯化工艺,优化试剂配比,最大限度的分离小分子荧光、失败的小分子片段和目标产物,我们的引物探针产品纯化效果优于市场平均水平,最高纯度可达98%。
|
|
| 常规纯化后的探针产物 | 必威升级纯化工艺后的探针产物 |
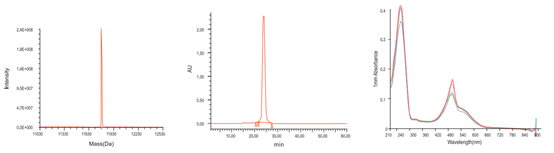
质检结果显示,必威生物制备的高质量探针,MS检测于理论分子量相同且无N±峰,HPLC检测纯度高达98%以上,荧光全波长扫描与对应参数一致。
References
【1】Hu WS, Hughes SH. HIV-1 Reverse Transcription. Cold Spring Harb Perspect Med. 2012 Oct 1;2(10):a006882. doi: 10.1101/cshperspect.
【2】Sun Y, Yu L, Liu C, Ye S, Chen W, Li D, Huang W. One-tube SARS-CoV-2 Detection Platform Based on RT-RPA and CRISPR/Cas12a. J Transl Med. 2021 Feb 16;19(1):74. doi: 10.1186/s12967-021-02741-5.
【3】Kia V, Tafti A, Paryan M, Mohammadi-Yeganeh S. Evaluation of Real-time NASBA Assay for the Detection of SARS-CoV-2 Compared with Real-time PCR. Ir J Med Sci. 2022 Jun 6;1–7. doi: 10.1007/s11845-022-03046-2
【4】Deurenberg RH, Bathoorn E, Chlebowicz MA, etc. Application of Next Generation Sequencing in Clinical Microbiology and Infection Prevention. J Biotechnol. 2017 Feb 10;243:16-24. doi: 10.1016/j.
【5】Soroka M, Wasowicz B, Rymaszewska A. Loop-Mediated Isothermal Amplification (LAMP): The Better Sibling of PCR? Cells. 2021 Jul 29;10(8):1931. doi: 10.3390/cells10081931.
【6】 Nowrousian M. Next-generation Sequencing Techniques for Eukaryotic Microorganisms: Sequencing-based Solutions to Biological Problems. Eukaryot Cell. 2010 Sep;9(9):1300-10. doi: 10.1128/EC.00123-10.
【7】 Ortiz-Cartagena C, Fernández-García L, Blasco L, etc. Reverse Transcription-Loop-Mediated Isothermal Amplification-CRISPR-Cas13a Technology as a Promising Diagnostic Tool for SARS-CoV-2. Microbiol Spectr. 2022 Sep 28:e0239822. doi: 10.1128/spectrum.02398-22.
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















